Son todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participa casi la totalidad de elementos conocidos.
Características
Las sustancias compuestas, o compuestos químicos, se dividen en dos grupos: orgánicos e inorgánicos.
Los compuestos inorgánicos son todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participa casi la totalidad de elementos conocidos. Son sustancias inertes o muertas, y se caracterizan por no contener carbono, como por ejemplo la cal, la sal de cocina, ácido de batería y otras, que son estudiadas por la Química inorgánica.
Los compuestos inorgánicos tienen altos puntos de fusión y de ebullición, debido a su enlace iónico el cual es fuerte y estructurado. El enlace covalente es comparativamente más fácil de debilitar por calentamiento, lo que hace que tengan bajos puntos de fusión y de ebullición.
Formación
Mientras que un compuesto orgánico se forma de manera natural tanto en animales como en vegetales, uno inorgánico se forma de manera ordinaria por la acción de distintas fuerzas físicas y químicas; electrólisis, fusión. También podrían considerarse agentes de la creación de estas sustancias a la energía solar, el agua, el oxígeno. Los enlaces que forman los compuestos inorgánicos suelen ser iónicos o covalentes.
Enlace Iónico
Es la atracción entre un átomo de un elemento de alta electronegatividad (no metal) y un átomo de un elemento de baja electronegatividad (metal). Debido a la considerable diferencia entre sus electronegatividades el metal le transfiere sus electrones de valencia al no metal. Se denomina enlace iónico porque al producirse la transferencia y la aceptación, los átomos se transforman en sus correspondientes iones positivo (catión) y negativo (anión).
Un ejemplo sencillo, es el enlace entre el sodio y el cloro para formar el cloruro de sodio. El sodio (Grupo IA) le transfiere su electrón de valencia al cloro transformándose en el ión sodio, Na+, y el cloro (Grupo VIIA) al recibir el electrón se convierte en el ión cloruro, Cl. En algunos casos, suele escribirse la fórmula del cloruro de sodio expresando las cargas iónicas, es decir como Na+ Cl-.
|
Los hidruros son compuestos binarios formados por átomos de hidrógeno y de otro elemento (pudiendo ser este, metal o no metal). Existen tres tipos de hidruros: los metálicos, los hidrácidos y los no metálicos. El hidrógeno es siempre monovalente y en el caso de los hidruros metálicos presenta un estado de oxidación de -1. Para saber la valencia que tiene un elemento cualquiera, al combinarse con el hidrógeno para formar el correspondiente hidruro, basta observar la tabla periódica y tener en cuenta la siguientes reglas:
Los elementos de las tres primeras columnas, presentan con el hidrógeno la valencia que indica el número de la columna, así, los de la primera columna son monovalentes, los de la segunda divalentes y los de la tercera trivalentes.
Para saber la valencia con el hidrógeno de los elementos de las columnas IV a VIII, se resta de 8 el número característico de la columna que ocupa el elemento. Así, los elementos de la columna V serán trivalentes porque 8-5=3.
Compuestos inorgánicos
Lo utilizan como agente desecante de disolventes orgánicos.
- Hidruro de Níquel (II) NiH2
Se utiliza como pila recargable.
Al mezclarlo con agua, puede hacer funcionar cualquier motor.
- Hidruro de Fósforo (III) PH3
La fosfina se utiliza principalmente en la fabricación de semiconductores el átomo de fósforo es un dopante para los productos de base Silicio Espitaxial (Contactos de emisores, fuentes o colectores).
- Hidruro de Nitrógeno (III) NH3
Se usa para limpiar y para desteñir los pelos. El amoniaco es un exitoso producto de limpieza. Su efectividad consiste en sus propiedades como desengrasante lo que lo hace útil para eliminar muchas difíciles. Se utiliza como limpia hogar divido en el agua.
- Hidruro de Amoniaco (III) NH3
Se usa para limpiar, sus propiedades básicas eliminan grasas ya que las convierte en sustancias fácilmente solubres.
- Hidruro de Metano (IV) CH4
Es un componente del gas natural y es utilizado como combustible.
|
|
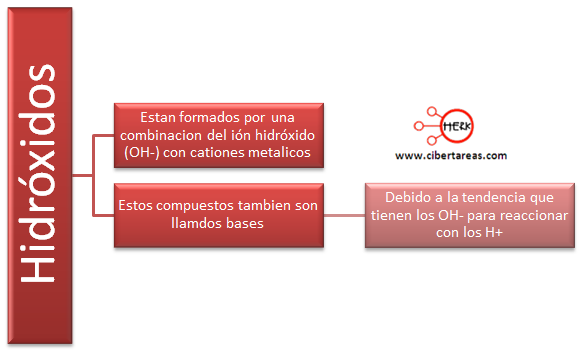
Los hidróxidos son un grupo de compuestos químicos formados por un metal y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
El hidróxido, combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases. No debe confundirse con hidroxilo, el grupo OH formado por un átomo de oxígeno y otro de hidrógeno, característico de los alcoholes y fenoles. Los hidróxidos se formulan escribiendo el metal seguido del grupo dependiente con la base de un ion de radical adecuado con hidroxilo; éste va entre paréntesis si el subíndice es mayor de uno. Se nombran utilizando la palabra hidróxido seguida del nombre del metal, con indicación de su valencia, situviera más de una. Por ejemplo, el Ni(OH)2 es el hidróxido de níquel (II) y el Ca(OH)2 es el hidróxido de calcio (véase Nomenclatura química).
Compuestos inorgánicos:
Se usa para elaborar papel o detergentes. En el hogar también se utiliza como elementos de limpieza.
- Hidróxido de Bario Ba(OH)2
Se usan para fabricar cerámicas, venenos para insectos, ratas y sustancias que se añaden a aceites y combustibles; el tratamiento de agua de alderas; en la producción de lubricantes de Bario; como componentes de sustancias para sellar, en la manufactura de papeles y refinación de azúcar; en la refinación de aceite animal y vegetal.
- Hidróxido Ferrico Fe(OH)3
Se utiliza para fertilizar plantas.
Se utiliza para elaborar jabones.
- Hidróxido de Zirconio (IV)
Se emplea en las industrias del vidrio de los tintes y pigmentos.
Se utiliza como colorante de cerámicas.
- Hidróxido de Aluminio Al(OH)3
Es un antiácido.
- Hidróxido de Amonio NH(OH)4
Se utiliza para extraer pigmentos, como refrigerante, en productos de limpieza, para el control de PH.
- Hidróxido de Estroncio Sr(OH)2
Es utilizado como estabilizador de plásticos, así como para los procesos de refinado del azúcar de remolacha.
- Hidróxido de Plata Ag(OH)4
Suele usarse en baterías (Baterías de oxido de Plata), así como para incrementar la oxidación en preparados químicos, como agente oxidante.
Suele utilizarse para dar color a cerámicas.
Las sales haloideas son sustancias que resultan de la combinación de un hidróxido con un hidrácido. Es una reacción de neutralización y se forma agua junto a la sal. Las sales están compuestas, básicamente, por un metal y un no metal, y dependiendo de si tienen oxígeno o no, pueden ser oxisales o sales haloideas.
Compuestos Inorgánicos:
El cloruro de sodio es una de las sales responsables de la salinidad del océano y del fluido extracelular de muchos organismos de muchos organismos. También es el mayor componente de la sal combustible es comúnmente usada como condimento y conservante de comida.

La mayoría del Cloruro de potasio producido es utilizado en la fabricación de fertilizantes, ya que el crecimiento de muchas plantas es limitado por el consumo de potasio.
|

Las sales neutras son compuestos formados por la reacción de un ácido con un hidróxido (compuesto ternario básico) formando también agua. Entre las sales neutras se encuentran las binarias y las ternarias, que se diferencian entre si por el ácido con el que reaccionan, siendo estos un hidrácido o un oxácido.
Cuando reacciona un ácido con un hidróxido para formar una sal neutra se combinan todos los cationes hidronio (H +1 ) con todos los aniones hidroxilo (OH -1 ). Los cationes H +1 son los que dan la propiedad de ácido a los hidrácidos y oxácidos, y los aniones OH -1 son los que dan propiedad de base a los hidróxidos, y cuando estos ácidos y bases reaccionan dan lugar a unaneutralización , que es la formación de agua, mientras que los iones restantes de la reacción forman una sal. Es por esta razón que estas sales reciben el nombre de "neutras".
Hidrácido + Hidróxido =====> Agua + Sal neutra
HCl + Na(OH)======> H2O + NaCl
Compuestos inorgánicos:
Debido a su contenido de nitrógeno se utiliza como fertilizante como aditiva para el cemento.
- Dicromato de potasio K4(Co)2
Se utiliza en la galvanotécnica para cromar otros metales en la fabricación del cuero, en la fabricación de pigmentos, como reactivo en la industria química.
Es usado frecuentemente en hogares, como oxidante en el proceso de potabilizacion del agua. También como desinfectante en piscinas.
Se emplea en la fabricación de vidrio y jabones, en la industria de la pulpa del papel.
Es usado frecuentemente en hogares, como oxidante en el proceso de potabilizacion del agua. también como desinfectante en piscinas.
|
|
Un hidrácido es un ácido que no contiene oxígeno sino que son compuestos binarios formados por un no metal (halógeno) e hidrógeno, y son los más simples. La nomenclatura diferencia las sustancias gaseosas de sus soluciones ácidas.
Compuestos Inorgánicos
Se utiliza para la obtención de compuestos orgánicos fluorados, como catalizador en petroquímica, para obtener Criulita (Na3ALF6) artificial que se emplea en la obtención del aluminio, fluoruros inorgánicos como el hexafluoruro de uranio (UF6) y aveces como disolvente. También es utilizado en la industria y preparación de Vidrio o cristal en el tallador y grabado del mismo.
![]()
Se utiliza para elaborar productos químicos y farmacéuticos, principalmente para la producción de bromuros inorgánicos, especialmente el bromuro de Zinc, calcio y sodio, también se lo empleo como solvente y en medición veterinaria. Es un reactivo útil para la regeneración de compuestos organobromados.
Se utiliza sobre todo como ácido barato, fuerte y volátil. El uso mas conocido es el de desincrustante para eliminar residuos de caliza (Carbonato calcio: CaCO3). En química orgánica se aprovecha el ácido clorhídrico a veces en la síntesis de cloruros orgánicos bien por por sustitución de un grupo Hidroxilo de un alcohol o por adición del ácido Clorhídrico un alqueno aunque a menudo estas reacciones no transcurren de una manera muy selectiva.
El HI es utilizado además en la química inorgánica para convertir alcoholes primarios en halogenoalcanos, esta reacción es un sustituto de SN2.
Se emplea en la marcha para precipitar los catones de metales pasados del grupo II de la marcha analítico, que luego se separan por otros metodos. Los precipitados amorfos pueden ser negros o blancos.
Se usa como envejecedor (Simulación de antigüedad) de bronces (Candados orfebrerías). También el Na2S se utiliza por ejemplo en preparación de cuero (Curtiduría) .
|
|
|
 Los ácidos oxácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O). Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición. Ejemplos: Ácido sulfúrico (H2SO4). Los ácidos oxácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O). Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición. Ejemplos: Ácido sulfúrico (H2SO4).
Compuestos inorgánicos
Ácido Nítrico HNO3
Se usa en grandes cantidades en la industria de los Abudos, colorantes,plásticos, explosivos, fabricación de medicamentos y grabado de metal.

Se utiliza en las industrias:
- Gaseosa: Para fabricación de bebidas carbonatadas (Gaseosas) y jardinería (Invernaderos).
- Líquida: Equipos de extensión incendios, cámaras de refrigeración.
- Solida: Como huelo seco para fabrica con de helado y alimentos congelados, uso en laboratorios y hospitales.
Es Utilizado para la fabricación de fertilizantes, detergentes, papel, la potabilización del agua, refigeracion de petroleo, procesamiento de metales.
Es muy útil en el laboratorio debido a su resistencia a la oxidación a la reducción y a la evaporación. Se emplea como ingrediente de bebidas no alcohólicas como por ejemplo la gaseosa y como pegamento de prótesis dentales.
|
|
|
|
 Los Óxidos Metálicos. Son combinaciones binarias de un metal con el oxígeno, en las que el oxígeno tiene número de oxidación (-2.) Los Óxidos Metálicos. Son combinaciones binarias de un metal con el oxígeno, en las que el oxígeno tiene número de oxidación (-2.)
Compuestos inorgánicos:
Es utilizado en los diferentes tipos de industria como: Hulera, plástico, adhesivos,reactivos químicos, esmaltes, fritas, cerámicas, vidrio, alfarería, cosmetología, farmacéutica, pinturas, tintas de presión cerillera, lubricantes, fertilizantes, productos alimenticios de aves y ganado.
Se emplea en diferentes procesos como: Elaboración de bacterias industriales, fabricaciones de pigmentos (Naranjas, amarillos y rojos), recubrimientos anticorrosivo.
Es empleado como material refractario.
Empleado como semiconductor en la elaboración de diodos rectificadores .
Propiedades narcóticas en la industria alimentaria se usa para hacer alimentos (Natas, yogures, estc) mas espumosos. Se utiliza también en combustible de los motores convencionales o en cohetes.
Se emplea en la producción de productos gasificados, como gaseosas o sodas.
Es la misma cal que se utiliza en preparación de cementos y morteros, en la obtención de hipoclorico de sodio que es el material fundamental de los blanqueadores domésticos.
Se emplea para trabajar metales y aleaciones de gran dureza.
Entre las funciones más importantes que cumple el oxido nítrico en el organismo, cabe mencionar el efecto modulador del tono vascular, neurotransmisor central y periférico inmunológico y la agregación plaquetario.
Se usan en la industria del vidrio. También se emplea para la preparación de venenos, colorantes y productos agroquímicos.
Son menas de estemal. La pirulusita se usa como colorante en la industria del vidrio pues al oxidarse a permanganato toma coloración violenta. También se emplea se emplea para la fabricación de pilas secas y en la obtención del oro.
Dada su rareza, no se usan en estado natural, si no que se obtienen artificialmente. Se utiliza en medicina para la preparación de famadas de uno oftalmológico.
Se emplea como desencante.
|
|
|
|
|
 Formación
Mientras que un compuesto orgánico se forma de manera natural tanto en animales como en vegetales, uno inorgánico se forma de manera ordinaria por la acción de distintas fuerzas físicas y químicas; electrólisis, fusión. También podrían considerarse agentes de la creación de estas sustancias a la energía solar, el agua, el oxígeno. Los enlaces que forman los compuestos inorgánicos suelen ser iónicos o covalentes.
Formación
Mientras que un compuesto orgánico se forma de manera natural tanto en animales como en vegetales, uno inorgánico se forma de manera ordinaria por la acción de distintas fuerzas físicas y químicas; electrólisis, fusión. También podrían considerarse agentes de la creación de estas sustancias a la energía solar, el agua, el oxígeno. Los enlaces que forman los compuestos inorgánicos suelen ser iónicos o covalentes.

 Enlace Iónico
Es la atracción entre un átomo de un elemento de alta electronegatividad (no metal) y un átomo de un elemento de baja electronegatividad (metal). Debido a la considerable diferencia entre sus electronegatividades el metal le transfiere sus electrones de valencia al no metal. Se denomina enlace iónico porque al producirse la transferencia y la aceptación, los átomos se transforman en sus correspondientes iones positivo (catión) y negativo (anión).
Un ejemplo sencillo, es el enlace entre el sodio y el cloro para formar el cloruro de sodio. El sodio (Grupo IA) le transfiere su electrón de valencia al cloro transformándose en el ión sodio, Na+, y el cloro (Grupo VIIA) al recibir el electrón se convierte en el ión cloruro, Cl. En algunos casos, suele escribirse la fórmula del cloruro de sodio expresando las cargas iónicas, es decir como Na+ Cl-.
Enlace Iónico
Es la atracción entre un átomo de un elemento de alta electronegatividad (no metal) y un átomo de un elemento de baja electronegatividad (metal). Debido a la considerable diferencia entre sus electronegatividades el metal le transfiere sus electrones de valencia al no metal. Se denomina enlace iónico porque al producirse la transferencia y la aceptación, los átomos se transforman en sus correspondientes iones positivo (catión) y negativo (anión).
Un ejemplo sencillo, es el enlace entre el sodio y el cloro para formar el cloruro de sodio. El sodio (Grupo IA) le transfiere su electrón de valencia al cloro transformándose en el ión sodio, Na+, y el cloro (Grupo VIIA) al recibir el electrón se convierte en el ión cloruro, Cl. En algunos casos, suele escribirse la fórmula del cloruro de sodio expresando las cargas iónicas, es decir como Na+ Cl-.































![]()

![]()


 Los ácidos oxácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O). Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición. Ejemplos: Ácido sulfúrico (H2SO4).
Los ácidos oxácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O). Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición. Ejemplos: Ácido sulfúrico (H2SO4).




 Los Óxidos Metálicos. Son combinaciones binarias de un metal con el oxígeno, en las que el oxígeno tiene número de oxidación (-2.)
Los Óxidos Metálicos. Son combinaciones binarias de un metal con el oxígeno, en las que el oxígeno tiene número de oxidación (-2.)









![]()







![]()





















No hay comentarios:
Publicar un comentario